
Bộ Y tế yêu cầu thu hồi lô thuốc điều trị ung thư vi phạm mức độ 3
Cục Quản lý Dược, Bộ Y tế vừa có văn bản thông báo thu hồi lô thuốc điều trị ung thư não, nhập khẩu từ Đức vì những sai phạm liên quan đến hướng dẫn sử dụng.
Theo báo cáo, lô thuốc bị thu hồi là Temozolomid Ribosepharm 100 mg, có số Giấy đăng ký lưu hành VN2-626-17, số lô 2J6001, sản xuất ngày 17/8/2022, hạn dùng 31/8/2025, do Công ty Haupt Pharma Amareg GmbH (Đức) sản xuất, Công ty TNHH Dược phẩm và hóa chất Nam Linh (thành phố Hồ Chí Minh) nhập khẩu. Thuốc này được dùng để điều trị một số loại ung thư não.
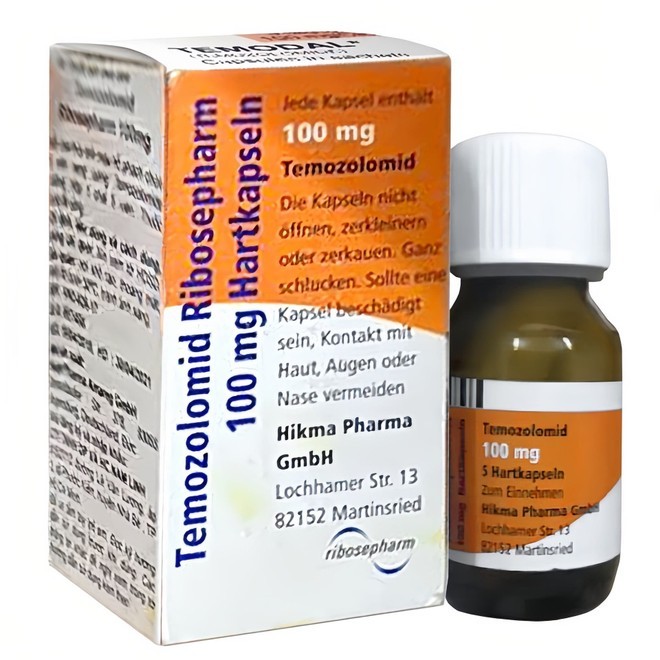
Sản phẩm thuốc được cho là vi phạm mức độ 3 bị yêu cầu thu hồi trên phạm vi cả nước.
Ông Tạ Mạnh Hùng, Phó Cục trưởng Cục Quản lý Dược ký cho biết, căn cứ Biên bản cuộc họp số 76/BB-QLD ngày 7/5/2024 giữa Cục Quản lý Dược, Thanh tra Bộ Y tế và các đơn vị liên quan về xử lý thuốc Temozolomid Ribosepharm 100 mg, số Giấy đăng ký lưu hành VN2-626-17, số lô 2J6001, sản xuất ngày 17/8/2022, hạn dùng 31/8/2025 không có tờ hướng dẫn sử dụng tiếng Việt.
Tại cuộc họp, căn cứ vào quy định hiện hành, các đơn vị tham gia cuộc họp đã xác định lô thuốc nêu trên vi phạm mức độ 3.
Theo quy định về quản lý thuốc, thuốc nhập khẩu vào Việt Nam mà trên nhãn gốc chưa thể hiện hoặc chưa đủ nội dung bắt buộc bằng tiếng Việt thì phải có nhãn phụ tiếng Việt, hướng dẫn sử dụng bằng tiếng Việt. Yêu cầu thu hồi toàn bộ lô thuốc trên trên phạm vi cả nước.
Sở Y tế các tỉnh thành phố, y tế các ngành thông báo cho cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc vi phạm mức độ 3 nêu trên, công bố thông tin về quyết định thu hồi thuốc trên trang thông tin điện tử của sở; kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và cơ quan chức năng có liên quan.
Sở Y tế Thành phố Hồ Chí Minh sẽ kiểm tra và giám sát Công ty TNHH Dược phẩm và hóa chất Nam Linh thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.
Link nội dung: https://saigonmoi24.com/bo-y-te-yeu-cau-thu-hoi-lo-thuoc-dieu-tri-ung-thu-vi-pham-muc-do-3-a103694.html